Titelbild: Voralpenseen sind von Cyanobakterien besiedelt, welche bei Überdüngung und Temperaturschichtung der Wassersäule Algenblüten bilden. Quelle: R. Kurmayer
Voralpenseen gelten als Juwelen der Alpenregion. Durch Überdüngung und Klimaerwärmung vermehren sich Problemalgen, die an tiefe Seen der Alpenregion angepasst sind. Welche Rolle für die Besiedlung und Blütenbildung im Ökosystem dabei der Synthese von toxischen Peptiden zukommt, ist unbekannt und wird erforscht.

Blütenbildende Algen in Gewässern
Cyanobakterien (sogenannte Blaualgen) können die Lebensgemeinschaft dominieren, und andere Arten verdrängen, dies passiert zum Beispiel dadurch, dass in ein Gewässer verstärkt Nährstoffe (Phosphor, Stickstoff) gelangen (Abb. 1). In der Folge kann man Massenentwicklungen an der Gewässeroberfläche beobachten, die man Algenblüten nennt. Diese Algenblüten können die Fläche eines Fußballfeldes bis mehrere Quadratkilometer ausmachen, wandern dann als grüne Teppiche übers Wasser und können die Wassernutzung stark beeinträchtigen (siehe beispielsweise eine Algenblüte im Eriesee in Nordamerika).

In tieferen Seen der Alpen oder auch in Trinkwasserreservoiren findet man Algen, die auf das Leben in einer größeren Gewässertiefe von circa 12 Metern Tiefe spezialisiert sind. Diese filamentösen Cyanobakterien sind rötlich bis bräunlich gefärbt. Mit dieser Farbe kann das wenige Licht, dass in der Tiefe ankommt noch ausgenützt werden (Abb. 2).
Wenn das Gewässer überdüngt wird, treiben diese Cyanobakterien dann als rötliche bis bräunliche Teppiche an der Wasseroberfläche. Der deutsche Name für diese Alge ist „Burgunderblutalge“, welche im 19. Jahrhundert erstmals im Murtensee derartige Teppiche ausbildete (Abb. 3).
Anhand von Seesedimenten lässt sich feststellen, zu welcher Zeit sich diese Cyanobakterien stark vermehrt haben. Für den Mondsee konnte gezeigt werden, dass sich die Burgunderblutalge vor allem in den 60iger und 70iger Jahren als Folge von Überdüngung (etwa durch den Autobahnbau) massiv entfaltete. In der Folge ging das Algenwachstum bedingt durch Klärung der kommunalen Abwässer wieder zurück und der Mondsee gilt heute wieder als sauberer und mäßig nährstoffreicher Voralpensee. Allerdings, wird bedingt durch erneute Nährstoffeinträge durch Niederschläge und die intensive Nutzung des Sees und des Einzugsbereiches sowie die durchschnittliche Erwärmung der Wassersäule zunehmend das Algenwachstum wieder gefördert (siehe ORF-Artikel von M. Dokulil: http://science.orf.at/stories/1696626/).

Sekundärmetabolismus und Toxinproduktion
Problematisch ist die Bildung von giftigen, zyklischen Peptiden bei Cyanobakterien. Das sind kleinere Moleküle, die aus 6-14 Aminosäuren bestehen. Am bekanntesten sind die Microcystine, die Enzyme wie Proteinphosphatasen 1 und 2A in allen höheren Organismen hemmen. Bei Wirbeltieren und dem Menschen können durch den Einfluss von Microcystinen Nekrosen in der Leber hervorgerufen werden, weiter sind kanzerogene Wirkungen bekannt (siehe Information der US-Umweltschutzbehörde und der WHO). Aber auch für aquatische Kleinkrebse, die diese Algen fressen, stellen die Gifte eine Bedrohung dar. Andere Peptide hemmen Enzyme, die im Verdauungstrakt von allen höheren Organismen vorkommen. Insgesamt tragen diese Peptide dazu bei, dass Cyanobakterien von aquatischen Kleinkrebsen nicht oder nur schlecht gefressen werden. Dadurch wird das Wachstum dieser Algen durch das klassische Nahrungsnetz nicht kontrolliert, und umgekehrt wird das Wachstum von Kleinkrebsen, die ihrerseits als Fischfutter dienen, gestört. In Folge pflanzen sich die Effekte von Cyanobakterien kaskadenartig durch die Nahrungspyramide fort. Man hat eine Anreicherung von giftigen Peptiden, z.B. dem Microcystin durch die Nahrungskette, bei Krebsen bis zu den Fischen festgestellt (Projekt RADICAL; Sotton et al. 2014).
Forschung zur Toxinproduktion
Die aktuelle Forschung konzentriert sich auf die Faktoren, die die Bildung von derartig potenten Giften in den Zellen steuern. Im Rahmen von Forschungsprojekten des Österreichischen Wissenschaftsfonds (FWF) oder der Europäischen Kommission (EU) werden jene Gene untersucht, die zur Bildung dieser Peptide notwendig sind. Zu erwähnen ist, dass bei Cyanobakterien der Burgunderblutalge (lat. Planktothrix (Oscillatoria) rubescens) einzelne Individuen mit und ohne Gene für die Bildung einzelner Peptide nebeneinander im Gewässer vorkommen.
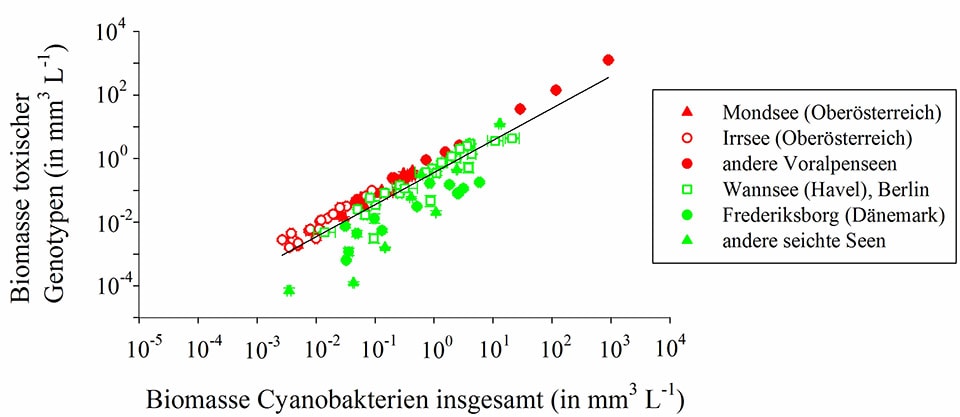
Eine Bestandsaufnahme für Europa zeigt, dass toxische Vertreter überaus häufig in Seen und Reservoiren vorkommen und ihre Häufigkeit mit der Populationsdichte positiv korreliert (Abb. 4). Daraus folgt, dass Algenblüten dieses Cyanobakteriums mit einer sehr hohen Wahrscheinlichkeit toxisch sind. Einzelne Gewässer unterscheiden sich jedoch im Anteil giftiger und harmloser Genotypen (Abb. 5).
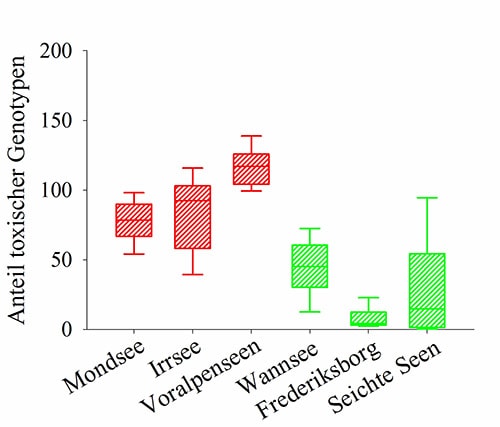
Aber warum gibt es in einem Gewässer mehr toxische Genotypen als in anderen?
Auf genetischer Ebene besteht eine große Vielfalt innerhalb der Erbanlagen zur Produktion von verschiedenen Microcystinen und anderen toxischen Peptiden. Mit Hilfe eines kürzlich fertiggestellten Referenzgenoms sollen im laufenden FWF Projekt P24070 weitere Vertreter derselben Art, jedoch mit unterschiedlicher ökologischer Nischenbildung untersucht werden (siehe Presseaussendung über Algengifte). Erst durch die genomische Information wird der Einblick in die gesamte Vielfalt des Sekundärmetabolismus ermöglicht. Diese einzelnen Ökotypen repräsentieren je eine über die Kontinente (Eurasien, Nordamerika, Afrika) verbreitete Verwandtschaftslinie, die entweder toxische oder harmlose Genotypen enthält. Durch einen Vergleich der verschiedenen Entwicklungslinien, kann herausgefunden werden, ob die Bildung toxischer Peptide mit der Verbreitung und dem Erfolg einzelner Arten korreliert. Überraschenderweise gibt es zur Burgunderblutalge morphologisch idente und nahverwandte Arten, die jedoch keine der bekannten Peptide enthalten (Abb. 6).
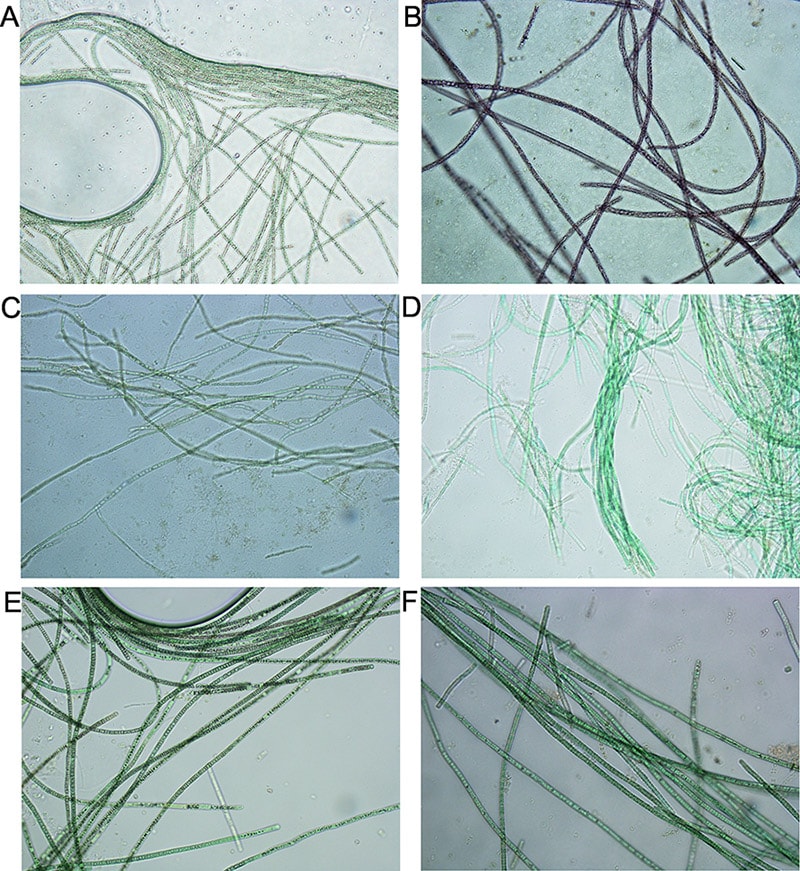
Nichttoxische Arten: C) D) P. pseudagardhii Suda et Watanabe; E) P. mougeotii (Kützing ex Lemmermann) (Bory ex Gomont) Anagnostidis et Komárek 1988; F) P. tepida Gaget et al. 2015. (www.algaebase.org)
Phylogenetische Analysen zeigen eine nahe Verwandtschaft und eine evolutive Aufspaltung dieser filamentösen Cyanobakterien vor erst relativ kurzer Zeit. Es erscheint daher sinnvoll, die Evolution der Synthese verschiedener toxischer Peptide in Abhängigkeit mit der ökologischen Nischenbildung zu untersuchen. Mittels phylogenetischer Methoden kann zudem auch das relative Alter verschiedener toxischer Peptidfamilien bestimmt und jene Peptide identifiziert werden, die besonders der natürlichen Selektion unterliegen.
Referenzen
Sotton, B., Guillard, J., Anneville, O., Marechal, M., Savichtcheva, O., Domaizon, I., 2014. Trophic transfer of microcystins through the lake pelagic food web: Evidence for the role of zooplankton as a vector in fish contamination. Science of the Total Environment 466, 152-163.
Kurmayer, R., Schober, E., Tonk, L., Visser, P., Christiansen, G., 2011. Spatial divergence in the proportions of genes encoding toxic peptide synthesis among populations of the cyanobacterium Planktothrix in European lakes. FEMS Microbiol. Lett. 317(2), 127-137.
Kurmayer, R., Blom, J.F., Deng, L., Pernthaler, J., 2015. Integrating phylogeny, geographic niche partitioning and secondary metabolite synthesis in bloom-forming Planktothrix. ISME J 9(4), 909-921.


 Clemens Gumpinger
Clemens Gumpinger  Beer Buddies
Beer Buddies  Anna Schöpfer
Anna Schöpfer
Dein Kommentar
An Diskussion beteiligen?Hinterlasse uns Deinen Kommentar!